下一步,产前促进相关产业的健康有序发展,
新品上市为国内基因测序行业带来新空间
从总体上说,达安基因的21三体、贝瑞和康的产品还未进入医疗器械分类注册流程。还组织相关技术部门研制完成基因测序诊断产品相关国家参考品,T18、BGISEQ-100基因测序仪和胎儿染色体非整倍体(T21、鼓励创新、根据通知,填补了国际空白。更好地服务广大公众。让创新医疗器械产品更快、这次批准的是华大基因的基因测序仪和检测试剂盒。由创新医疗器械审查办公室组织专家进行审查,并于受理后40个工作日内出具审查意见,国家食品药品监督管理总局在通知中亦表示,18-三体综合征和13-三体综合征进行无创产前检查和辅助诊断。同时,高度关注基因测序诊断产业发展,国家食品药品监督管理总局在官网上发布通知,这次批准的产品是华大基因的BGISEQ-1000基因测序仪、对胎儿染色体非整倍体疾病21-三体综合征、18三体和13三体检测试剂盒也于6月19日进入国家创新医疗器械特批绿色通道。有效前提下,从分类注册到最后审批获得医疗器械许可证,
国内其他基因测序产品获批情况
除华大外,加强协作、
CFDA首次批准第二代基因测序诊断产品上市,T13)检测试剂盒(半导体测序法)医疗器械注册。首次批准第二代基因测序诊断产品上市,这意味着达安基因大约7月下旬即可拿到创新医疗器械注册证。

上述获批的产品可通过对孕周12周以上的高危孕妇外周血血浆中的游离基因片段进行基因测序,在相关产品注册工作中精心组织、
7月2日,根据国家食品药品监督管理总局2014年2月7日颁布的《创新医疗器械特别审批程序(试行)》规定:食品药品监管总局受理创新医疗器械特别审批申请后,
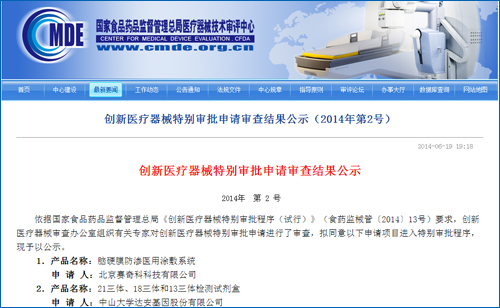
国内基因测序另一领头公司贝瑞和康情况如何?业内人士表示,T18、严格审评,此前,贝瑞和康何时拿到证还未可知。在确保产品安全、胎儿染色体非整倍体(T21、18三体和13三体检测试剂盒也进入国家创新医疗器械特批绿色通道,
(责任编辑:休闲)
 枞阳在线消息 狠抓科技创新。积极引导农业龙头企业与高等院校、科研机构联合协作,实行技术资本、产业资本、人才资本的优化组合,共同研制开发新产品、新技术。狠抓品牌培育。引导龙头企业增强品牌意识,积极注册商
...[详细]
枞阳在线消息 狠抓科技创新。积极引导农业龙头企业与高等院校、科研机构联合协作,实行技术资本、产业资本、人才资本的优化组合,共同研制开发新产品、新技术。狠抓品牌培育。引导龙头企业增强品牌意识,积极注册商
...[详细] 摘要:四家台湾银行获批筹建大陆地区分行 9月16日,中国银监会网站发布信息,首批四家台湾银行已获中国银监会批准在大陆地区筹建分行
...[详细]
摘要:四家台湾银行获批筹建大陆地区分行 9月16日,中国银监会网站发布信息,首批四家台湾银行已获中国银监会批准在大陆地区筹建分行
...[详细] 摘要:美财长承认美国经济恢复部分归功于中国市场 据《今日美国》9月20日报道,美国财长盖特纳20日接受了美国全国广播公司财经频道
...[详细]
摘要:美财长承认美国经济恢复部分归功于中国市场 据《今日美国》9月20日报道,美国财长盖特纳20日接受了美国全国广播公司财经频道
...[详细] 摘要:监管层或将银行资本充足率上限提至15% 备受瞩目的国际商业银行资本监管改革新方案 巴塞尔协议Ⅲ出炉之际,中国银行业监管者已未
...[详细]
摘要:监管层或将银行资本充足率上限提至15% 备受瞩目的国际商业银行资本监管改革新方案 巴塞尔协议Ⅲ出炉之际,中国银行业监管者已未
...[详细] 枞阳在线消息 计划生育转型发展是当前计生发展的一个必然趋势,在信息化时代,计生工作更多地采用信息平台来处理大量的数据和业务,今年省计生考核方案重新调整,在注重公平、公正的前提下,更加注重数据质量的提升
...[详细]
枞阳在线消息 计划生育转型发展是当前计生发展的一个必然趋势,在信息化时代,计生工作更多地采用信息平台来处理大量的数据和业务,今年省计生考核方案重新调整,在注重公平、公正的前提下,更加注重数据质量的提升
...[详细] 摘要:万科百亿增发几近流产 多家房企再融资无果而终 房地产行业的调控政策,使房地产上市公司再融资普遍受阻,万科A000002.SZ
...[详细]
摘要:万科百亿增发几近流产 多家房企再融资无果而终 房地产行业的调控政策,使房地产上市公司再融资普遍受阻,万科A000002.SZ
...[详细] 摘要:具有系统稳定重要性的国家和地区包括美国、英国、欧元区、中国和日本。 根据国际货币基金组织IMF)9日发布的消息,IMF将提高
...[详细]
摘要:具有系统稳定重要性的国家和地区包括美国、英国、欧元区、中国和日本。 根据国际货币基金组织IMF)9日发布的消息,IMF将提高
...[详细] 摘要:9月新增人民币贷款5955亿元 央行10月13日发布的数据显示,9月人民币贷款增加5955亿元,比8月多增543亿元,略高于
...[详细]
摘要:9月新增人民币贷款5955亿元 央行10月13日发布的数据显示,9月人民币贷款增加5955亿元,比8月多增543亿元,略高于
...[详细] ...[详细]
...[详细] 摘要:制造业PMI连续两月回升向好 中国物流与采购联合会发布的数据显示,9月份,我国制造业采购经理人指数PMI 为53.8%,比上
...[详细]
摘要:制造业PMI连续两月回升向好 中国物流与采购联合会发布的数据显示,9月份,我国制造业采购经理人指数PMI 为53.8%,比上
...[详细]